Structura, proprietățile și funcțiile proteinelor
Structura proteinelor
Proteine - compuși organici cu greutate moleculară mare care constau din resturi de a-aminoacizi.
Compoziția de proteine include carbon, hidrogen, azot, oxigen, sulf. O parte a proteinei complexat cu alte molecule care conțin fosfor, fier, zinc și cupru.
Proteinele au greutate moleculară ridicată: ovalbumina - 36.000, hemoglobina - 152 000 miozina - 500 000. Pentru comparație, alcoolul greutate moleculară - 46 Acid acetic - 60 benzen - 78.
Compoziția de aminoacizi a proteinelor
Proteine - polimeri nonperiodic, monomeri care sunt α-aminoacizi. De obicei, monomerii de proteine numite 20 tipuri de a-aminoacizi, cu toate că în celulele și țesuturile au descoperit mai mult de 170.
În funcție de faptul dacă aminoacidul sintetizat în corpul oamenilor și a altor animale, se disting: aminoacizi esențiali - pot fi sintetizați; aminoacizi esențiali - nu pot fi sintetizate. aminoacizi esențiali trebuie să fie ingerate cu alimente. Plantele sintetiza toate tipurile de aminoacizi.
În funcție de compoziția de aminoacizi a proteinelor sunt: grad înalt - conține întregul set de aminoacizi; inferior - unii aminoacizi sunt absenți în compoziția lor. În cazul în care proteinele sunt compuse numai din aminoacizi, acestea sunt numite simplu. Dacă proteinele conțin aminoacizi altele decât componenta chiar și non-aminoacizi (grupare prostetică), denumit complex. Gruparea prostetică poate fi reprezentat metale (metaloproteinelor), glucide (glicoproteine), lipide (lipoproteine), acizi nucleici (nucleoproteine).
Toți aminoacizii conțin. 1) o grupare carboxil (COOH) 2) grupare amino (-NH2), 3) sau un R-grup radical (restul moleculei). Structura radicală în diferite tipuri de aminoacizi - diferite. În funcție de numărul de grupări amino și grupări carboxil care fac parte din aminoacizi se disting: aminoacizi neutri. având o grupare carboxil și o grupare amino; aminoacizi bazici. având mai mult de o grupă amino; aminoacizi acizi. având mai mult de o grupare carboxil.
Aminoacizii sunt compuși amfoterici. deoarece în soluție pot acționa atât ca acizi și baze. În soluții apoase, aminoacizi există în diferite forme ionice.
legătură peptidică
Peptidele - substanțe organice compuse din resturi de aminoacizi unite prin legături peptidice.
Formarea peptidelor rezultă din reacția de condensare a aminoacizilor. Când gruparea amino a unei interacțiuni de aminoacizi cu gruparea carboxil a unui alt loc între acestea covalentă legătură azot-carbon, care sunt numite peptide. În funcție de numărul de resturi de aminoacizi care cuprinde peptida distinge dipeptide, tripeptide tetrapeptide etc. Formarea legăturii peptidice poate fi repetată de mai multe ori. Aceasta conduce la formarea de polipeptide. La un capăt este o peptidă liberă grupă amino (numită N-end), iar celălalt - gruparea carboxil liberă (numit C-terminal).
Organizarea spațială a moleculelor de proteine
Executarea anumitor proteine funcții specifice care depind de configurația spațială a moleculelor în plus, colivia energetic nefavorabil menține proteine în formă extinsă, ca un lanț, astfel încât lanțurile polipeptidice expuse pozare definit structura dobândirea tridimensională sau conformație. 4 niveluri de organizare spațială a proteinelor.
Structura primară a proteinei - o secvență de resturi de aminoacid localizarea în lanțul polipeptidic al componentei moleculei de proteină. Comunicarea dintre aminoacizii - Peptide.
Dacă molecula de proteină constă din numai 10 resturi de aminoacizi, numărul teoretic posibile variante ale moleculelor de proteină cu diferite aminoacizi, pentru alternarea - 10 20. Cu 20 de aminoacizi, pot face din ei o varietate mai mare de combinații. La om, ordinea observată a zece mii de proteine diferite, care diferă unul de altul și de proteinele altor organisme.
Este structura primară a moleculei de proteină determină proprietățile proteinei și configurația spațială. Înlocuirea doar un aminoacid cu altul în lanțul polipeptidic conduce la o schimbare a proprietăților și funcția proteinei. De exemplu, înlocuirea unei β subunității a hemoglobinei glutamic sasea aminoacid valină conduce la faptul că molecula de hemoglobină ca întreg nu poate îndeplini funcția de bază - transportul de oxigen; în astfel de cazuri, o persoană care se dezvolta boala - siclemie.
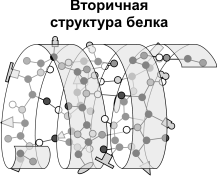
Structura secundară - o pliere ordonată a lanțului polipeptidic într-o spirală (arată primăvară întinsă). Spirala transformă legături de hidrogen puternice care apar între grupările carboxil și grupări amino. Practic, toate grupurile de CO și NH sunt implicate în legarea hidrogenului. Ele sunt mai slabe decât peptida, dar a repetat de multe ori, această configurație conferă stabilitate și rigiditate. Proteinele există la nivelul structurii secundare: fibroină (mătase, păianjen pânze), keratină (păr, unghii), colagen (tendon).
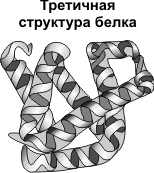
structura terțiară - stabilire lanțuri de polipeptide în globulele care rezultă din apariția legăturilor chimice (hidrogen, ionic, disulfidice) și stabilirea interacțiunilor hidrofobe dintre radicalii de resturi de aminoacizi. Rolul principal în formarea structurilor terțiare joacă un interacțiuni hidrofil-hidrofob. În soluție apoasă radicalii hidrofobi tind să se ascundă de apa globulelor sunt grupate în interior, în timp ce radicalii hidrofili prin hidratarea (reacția cu dipolii apa) tind să fie pe suprafața moleculei. Unele structuri terțiare proteină stabilizate prin disulfidice legături covalente apărute între cei doi atomi de sulf din resturile de cisteină. La nivelul structurii terțiare, există enzime, anticorpi, unii hormoni.
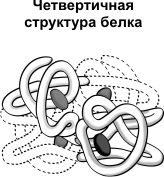
Structura cuaternară a proteinelor caracteristice complexe, moleculele care sunt formate din două sau mai multe globulelor. Subunitățile sunt ținute într-o moleculă, datorită interacțiunilor ionice, hidrofobe și electrostatice. Uneori, formarea structurii cuaternare apar între subunitățile legături disulfidice. Proteina cea mai studiată având structura cuaternară este hemoglobină. Se compune din două subunități a-(141 resturi ale aminoacizilor) și două subunități p (146 resturi de aminoacizi). Pe fiecare subunitate legată moleculă hem care cuprinde fier.
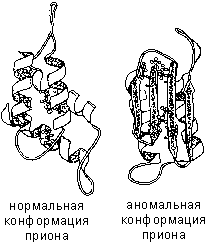
Dacă, din orice motiv, conformația spațială a proteinei se abate de la proteina normală nu poate îndeplini funcțiile sale. De exemplu, cauza „boala vacii nebune“ (encefalopatie spongiformă bovină) este o conformație anormală a prion - proteinele de suprafață ale celulelor nervoase.
proprietăți ale proteinelor
Compoziția de aminoacizi, structura moleculei proteice determină proprietățile sale. Proteinele se combină proprietățile de bază și acide definite de radicali de aminoacizi: aminoacizii mai acide într-o proteină, cu atât mai pronunțată proprietățile sale acide. Capacitatea de a atașa și livra H + tamponare proprietăți ale proteinelor este determinată; una dintre cele mai puternice tamponul - hemoglobina din celulele roșii din sânge, menținând pH-ul sanguin la un nivel constant. Sunt proteine solubile (fibrinogen), există insolubile care îndeplinesc funcții mecanice (fibroină, keratina, colagen). Orice proteine active de vedere chimic (enzime), este chimic inactiv, rezistent la diferite condiții de mediu și extrem de instabilă.
factori externi (căldură, radiații ultraviolete, metale grele și sărurile lor, modificări ale pH-ului, radiație, deshidratare)
poate provoca o încălcare a organizării structurale a moleculelor proteice. Pierderea conformația tridimensională a proteinei inerente in molecula, numita Denaturarea. Motivul este decuplarea Denaturarea, o anumită stabilizare a structurii proteinei. Inițial rupt cea mai slabă conexiune, în timp ce înăsprirea condițiilor și mai puternice. De aceea cuaternară a pierdut mai întâi, apoi o structură secundară și terțiară. Modificări în configurația spațială conduce la o modificare a proprietăților de proteine și, în consecință, face imposibilă executarea funcției sale de proteine inerente biologice. În cazul în care Denaturarea nu este însoțită de distrugerea structurii primare, poate fi reversibilă. în acest caz, caracteristica de auto-vindecare a conformației proteinelor. O astfel de denaturare expuse, de exemplu, proteine receptor de membrană. Procesul de recuperare după denaturare a structurii proteinei numite renaturare. Dacă restaurarea configurației spațiale a proteinei nu este posibilă, Denaturarea este numit ireversibil.