Proteine - l
proteine
(Proteine), clasa de compuși cu azot complexe, componentele de materie vie cele mai tipice și importante (împreună cu acizi nucleici). Proteinele indeplinesc multe și variate funcții. Cele mai multe proteine - enzime care catalizează reacții chimice. Multe dintre hormonii care regleaza procesele fiziologice sunt de asemenea proteine. Astfel de proteine structurale, cum ar fi keratina si colagen, sunt principalele componente ale oaselor, parului si unghiilor. proteinele contractile musculare au capacitatea de a schimba lungimea sa, folosind energia chimică pentru a realiza un lucru mecanic. Pentru proteine includ anticorpi care se leagă și neutralizează substanțele toxice. Unele proteine sunt capabile de a răspunde la stimuli externi (lumina, miros), servesc ca receptori organe de simț, simțind iritarea. Multe proteine, localizate intracelular și pe membrana celulară, care îndeplinesc funcții de reglementare. În prima jumătate a secolului al 19-lea. mulți chimiști, printre care în primul rând Yu.fon Liebig, a ajuns treptat la concluzia că proteinele sunt o clasă specială de compuși de azot. Numele de „proteine“ (din protos grecești. - primul) propus în 1840 un chimist olandez G.Mulder.
PROPRIETĂȚI FIZICE
Proteine în soluție alb și incolor solid, în cazul în care nu poartă nici o cromoforului (colorate), grupe, cum ar fi hemoglobina. Solubilitate în apă pentru proteine diferite variază foarte mult. Aceasta variază, de asemenea, în funcție de concentrația de pH și sare a soluției, astfel încât este posibil să se selecteze condițiile în care unii o proteină se precipită în mod selectiv, în prezența altor proteine. Această metodă de „sărare-out“ este utilizat pe scară largă pentru izolarea și purificarea proteinelor. Proteina purificată este adesea precipită din soluție sub formă de cristale. În comparație cu alți compuși cu greutate moleculară a proteinelor este foarte mare - de la câteva mii la mai multe milioane de Daltoni. Prin urmare, proteinele sunt precipitate prin ultracentrifugare, și mai mult decât atât, cu viteze diferite. Datorită prezenței în moleculele de proteine încărcate pozitiv și negativ grupurile care se deplasează cu viteze diferite și într-un câmp electric. Pe baza acestei electroforeză - metoda utilizată pentru izolarea proteinelor individuale din amestecuri complexe. Purificarea proteinelor și este realizată prin cromatografie.
PROPRIETĂȚI CHIMICE
Structura. Proteinele - sunt polimeri, de exemplu, molecule construite ca lanțuri de repetarea unităților monomere sau subunități, rolul lor de acizi a-amino. Formula totală de aminoacizi
unde R - un atom de hidrogen sau orice grupare organică. moleculă de proteină (lanț polipeptidic) poate consta dintr-un număr relativ mic de aminoacizi sau a mai multor mii de unități monomerice. Compus de aminoacizi în lanțul este posibil, deoarece fiecare dintre ele există două grupuri diferite: chimice având proprietăți de bază ale grupării amino, NH2, și o grupare carboxil acidă, COOH. Ambele grupuri sunt atașate la atomul de carbon a. Gruparea carboxil a unui aminoacid poate forma o legătură amidică (peptidă) cu gruparea amino a unui alt aminoacid:
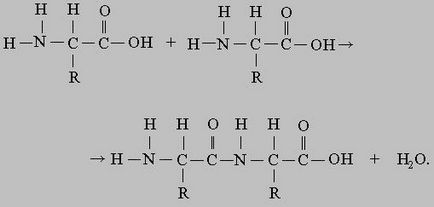
După doi aminoacizi, astfel conectate, circuitul poate fi crescută prin adăugarea de al treilea la al doilea aminoacid, etc. După cum se vede din ecuația de mai sus, formarea legăturii peptidice a moleculei de apă este eliberată. În prezența acizi, baze sau enzime proteolitice în reacția are loc pe direcția inversă, lanțul polipeptidic este clivat la aminoacizi cu adăugare de apă. O astfel de reacție se numește hidroliză. Hidroliza are loc spontan, și pentru conectarea aminoacizilor într-o catenă polipeptidică necesită energie. O grupare carboxil și o grupare amidă (sau o structură similară imidă ei - în cazul aminoacidului prolină) are toți aminoacizii, diferențele dintre aminoacizii determinate de natura grupei, sau „catena laterală“, care este desemnată de litera R. Rolul lanțului lateral de mai sus poate de asemenea juca un un atom de hidrogen, ca și în aminoacizii glicină, și orice rest de voluminos ca în histidină și triptofan. Anumite catene laterale în sens chimic inert, în timp ce alții prezintă reactivitate apreciabil. Sintetiza pot fi mai multe mii de diferiți aminoacizi, și o multitudine de aminoacizi diferiți se găsesc în natură, dar pentru proteina de sinteza este de numai 20 de tipuri de aminoacizi: alanină, arginină, asparagină, acid aspartic, valină, histidină, glicină, glutamină, acid glutamic, izoleucina, leucina, lizina , metionină, prolină, serină, tirozină, treonina, triptofan, fenilalanină și cisteină (cisteină în proteine poate fi prezent ca un dimer - cistină). Cu toate acestea, unele proteine sunt prezente și alți aminoacizi, în plus față de care apar în mod regulat douăzeci, dar ele sunt formate ca urmare a unei modificări a douăzeci și enumerate după ce a fost implicat în proteine.
Activitatea optică. Toți aminoacizii, cu excepția glicinei, un atom a atomului de carbon din cele patru grupe diferite sunt atașate. Din punct de vedere al geometriei, patru grupe diferite pot fi atașate în două moduri, și, astfel, există două configurații posibile, doi izomeri sau legate unul de altul, ca un subiect de reflecție sale specular, adică, mâna stângă spre dreapta. One configurație este cunoscută stânga sau levogir (L), iar celălalt - dreapta sau dextrogir (D), pentru că cei doi izomeri diferă în direcția de rotație a planului luminii polarizate. In proteine care se găsesc acizi numai L-amino (cu excepția glicinei, deoarece acesta poate fi reprezentat de o singură formă, deoarece are două dintre cele patru grupuri sunt aceleași), și ei sunt optic activi (deoarece există doar un singur izomer). D-aminoacizi sunt rare în natură; ele se găsesc în unele antibiotice și peretele celular al bacteriilor.
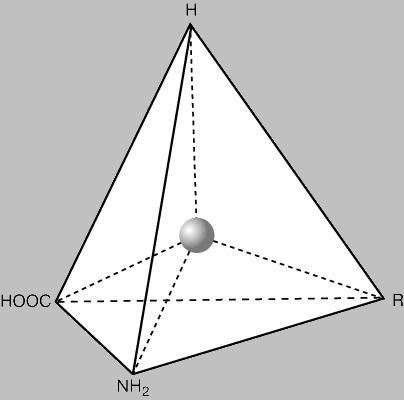
atom de carbon asimetric în molecula de aminoacid este reprezentat aici ca o minge plasată în centrul tetraedrului. Reprezentat de amplasarea celor patru grupe substituente corespunzând L-configurație, caracteristică tuturor aminoacizilor naturali.