De bază procese termodinamice blog despre energie
Principalele procese in termodinamica sunt:
- Helmholtz. care curge la volum constant;
- izobară. care curge la presiune constantă;
- izotermă. având loc la o temperatură constantă;
- adiabatic. în care schimbul de căldură cu mediul este absent;
- politropice. satisfacerea pv ecuația n = const.
Izocoră, izobară, izoterme și procesele adiabatice sunt cazuri speciale ale unui proces politropic.
In studiul proceselor termodinamice este determinată de:
- Ecuația de proces în p-v-s și t coordonatele;
- Relația dintre parametrii de stare a gazului;
- variația energiei interne;
- Valoarea lucrărilor externe;
- Rezumând cantitatea de căldură pentru punerea în aplicare a procesului sau cantitatea de căldură captată.
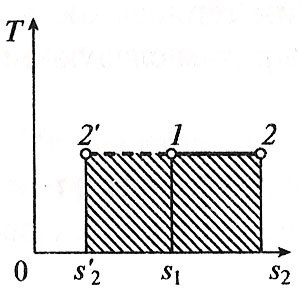
proces izocoră
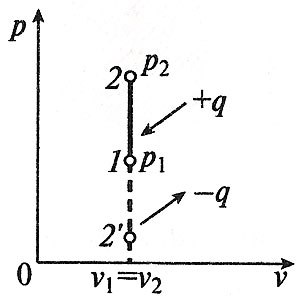
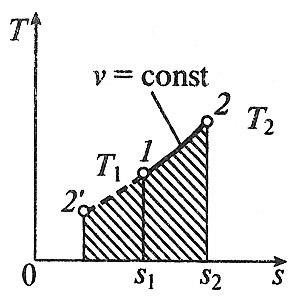
Când procesul de izocoră, starea v = const.
Din ecuația de stare de gaz ideal (pv = RT) urmează:
presiune gaz .. Ie este direct proporțională cu temperatura absolută:
extinderea procesului de muncă izocoră este zero (l = 0), deoarece volumul fluidului de lucru nu se schimbă (= const Av).
Cantitatea de căldură furnizată către fluidul de lucru în procesul de 1-2 cv = const este determinată de formula:
T. K.L = 0, pe baza primei legi a termodinamicii = q AU. și, prin urmare, variația energiei interne poate fi determinată prin formula:
Schimbarea în entropiei în procesul izocoră se determină prin formula:
proces izobară
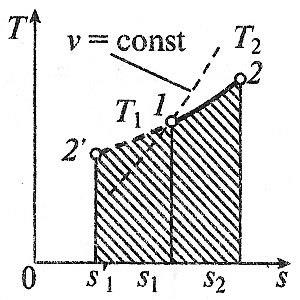
Se numește proces izobară care apar la presiune constantă p = const. Din ideală slueduet legea gazelor:
t. e. în volumul izobară de gaz de proces proporțională cu temperatura absolută.
Munca va fi egal cu:
Cantitatea de căldură la cp = const este determinat prin formula:
Modificarea entropiei va fi egală cu:
proces izoterma
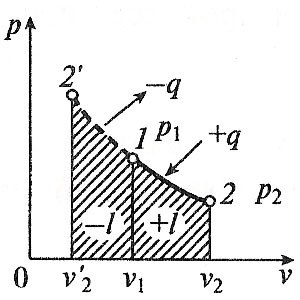
Când procesul izoterm temperatura de lucru a fluidului rămâne constantă T = const, deci:
.. presiune Ie și volumul sunt invers proporționale între ele, astfel încât o comprimare izotermă a crește presiunea gazului, iar în timpul expansiunii - este redusă.
Procesul de lucru va fi:
Deoarece temperatura rămâne constantă, iar energia internă a unui gaz ideal într-un proces izoterm rămâne constantă (= 0 DU) și furnizat toată căldura fluidului de lucru este complet transformată în lucru de expansiune:
Pentru comprimarea izotermă a fluidului de lucru căldura eliminată într-o cantitate de muncă cheltuită pentru compresie.
Schimbarea entropiei este:
proces adiabatic
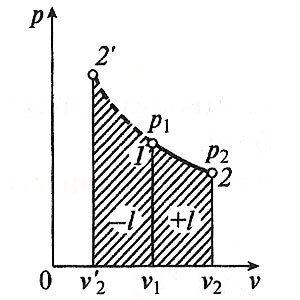
Proces numit schimbări adiabatice, în stare de gaz, care proiszodit fără schimb de căldură cu mediul înconjurător. Din moment ce dq = 0, atunci ecuația primei legi a termodinamicii pentru procesul adiabatic va arata:
Într-un proces adiabatic activitatea de expansiune se face doar în detrimentul energiei interne a consumului de gaz, și de compresie, care apare ca urmare a acțiunii forțelor externe, toată munca se face de ei pentru a crește energia internă a gazului.
Notăm căldura specifică într-un proces adiabatic prin grădină. și starea DQ = 0 exprimată după cum urmează:
Această condiție indică faptul că căldura specifică în procesul adiabatic este egal cu zero (= 0 Garden).
și o ecuație a procesului curbei adiabatică (adiabatică) în p, v -diagram are forma:
În această expresie, k se numește indicele adiabatic (cum este numit raportul Poisson).
Valorile indicelui de adiabatykdlya unele gaze:
kperegretogo pereche = 1.3
kvyhlopnyh gaze de ardere internă = 1,33
knasyschennogo abur umed = 1,135
Din formula anterioară:
proces tehnic adiabatică de lucru (ltehn) egală cu diferența (i1-i2) entalpii începutul și sfârșitul procesului.
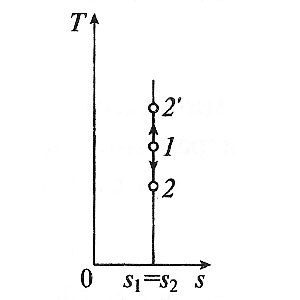
proces adiabatic are loc fără frecare internă în fluidul de lucru, se numește isentropic. In T, s -diagram este reprezentat printr-o linie verticală.
De obicei, procesele adiabatice reale rula în prezența frecării interne în fluidul de lucru, prin care căldura este întotdeauna alocat, care comunică cu fluidul de lucru. Apoi ds> 0, iar procesul se spune ca procesul adiabatic real.
proces politropic
Se numește un proces politropic, care este descris de ecuația:
politropic indice n poate lua orice valoare în intervalul de la -∞ la + ∞, dar acest proces este constant.
Din ecuația procesului politropic și Clapeyron poate fi obținută expresia, stabilirea relației dintre p, v și T la oricare două puncte de pe politropic:
Activitatea de expansiune a gazelor într-un proces politropic este:
In cazul acestei formule de gaz ideal poate fi convertit:
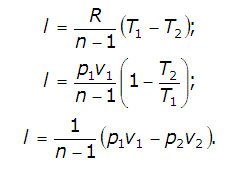
Însumare sau numărul atribuit în căldura de proces este determinată de prima lege a termodinamicii:
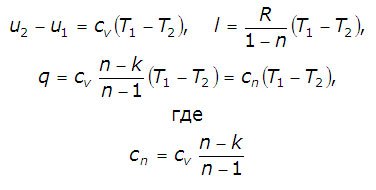
Reprezintă căldura specifică a unui gaz ideal într-un proces politropic.
Când cv. k și n = const cn = const, însă procesul politropic este uneori definit ca un proces de căldură specifică constantă.
proces Polytropic este o generalizare a valorii pentru acoperirea totalitatea proceselor termodinamice de bază.
Grafică politrope reprezentare în p, v coordonatele, în funcție de indicele de politropic n.
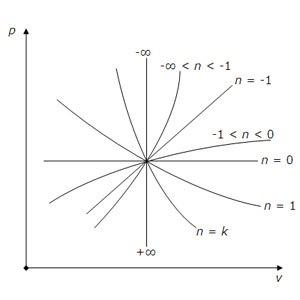
pv 0 = const (n = 0) - izobară;
pv = const (n = 1) - izotermă;
p 0 v = const, p 1 / ∞ v = const, pv ∞ = const - isochore;
n> 0 - curbe hiperbolice,