Cum de a găsi entalpia de reacție
Unele reacții chimice pot absorbi sau emite mediu cald. Un astfel de transfer de căldură între reacția chimică și mediul înconjurător, se numește entalpia sau H. Cu toate acestea, este imposibil să se măsoare cu precizie schimbarea entalpie conta temperatura ambiantă, prin urmare, luate (notate AH). Indică faptul că o AH căldură reacție chimică este eliberată în mediul înconjurător (exoterm) sau absorbția de căldură (reacție endotermă). Entalpiei se calculează astfel: m = x A H s x AT, unde m - este greutatea reactanților, s - este căldura specifică, AT - diferența de temperatură este.
pași Editare
Metoda 1 de la 3:
Calculul Editare enthalpy
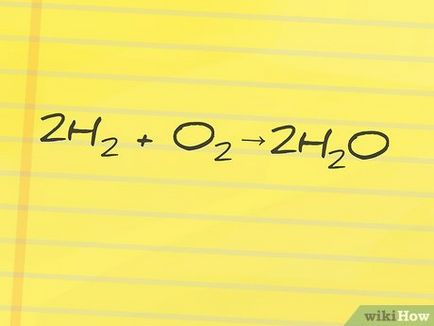
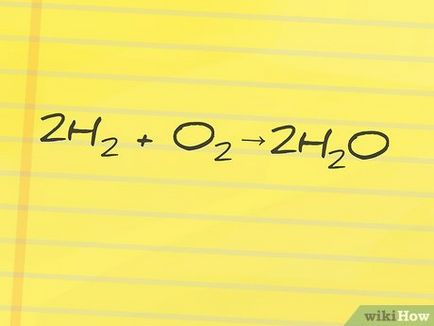
- De exemplu, este necesar să se găsească entalpia reacției de formare a apei din oxigen și hidrogen: 2H2 (hidrogen) + O2 (oxigen) → 2H2O (apă). În această reacție, H2 și O2 - l reactivi și H2O - un produs al reacției.
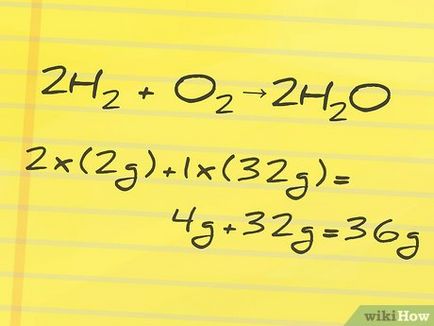
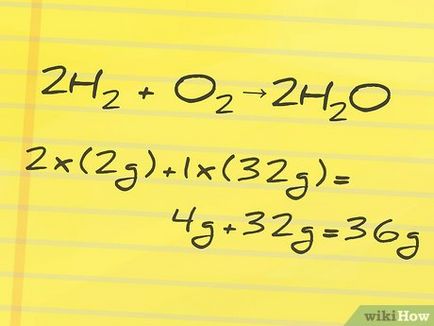
- În exemplul nostru, reactanți, hidrogen și oxigen, au greutăți moleculare de 2 g și, respectiv, 32 g. Din moment ce folosim 2 moli de hidrogen (coeficientul într-o reacție chimică înaintea H2 hidrogen) și 1 mol de oxigen (absența coeficientului de O2 este de 1 mol), masa totală a reactanților se calculează după cum urmează:
2 x (2r) + 1 x (32g) = 4g + 32g = 36g
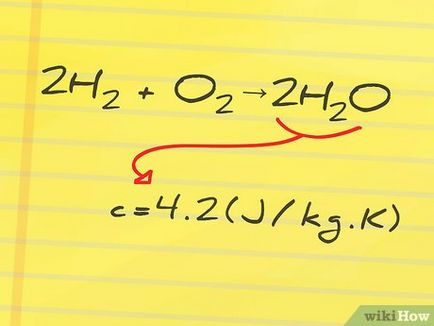
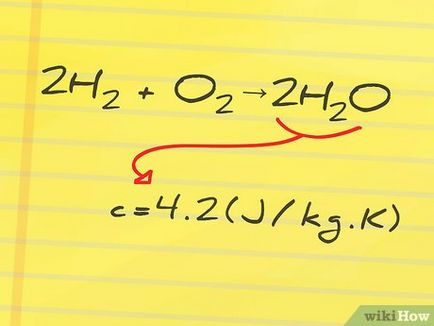
- Vă rugăm să rețineți că, dacă aveți mai multe produse de reacție, trebuie să se calculeze capacitatea calorică a fiecărui, și apoi adăugați-le pentru a obține entalpia reacției.
- In exemplul nostru, produsul de reacție - apă, care are o căldură specifică de 4,2 J / g ° C


- În exemplul nostru, să presupunem că temperatura inițială de reacție a fost 185K și 95K după începerea reacției, prin urmare ,? T se calculează după cum urmează:
T2 = AT - T1 = 95K - 185K = -90K


- În exemplul nostru, entalpia se calculează după cum urmează:
= AH (36g) x (4.2 DzhK-1 g-1) x (-90K) = -13,608 J.


- În exemplul nostru, rezultatul final este egal cu -13,608 J. Înainte valoare negativă entalpie, ceea ce înseamnă că reacția este exotermă. gaz fierbinte (sub formă de vapori) H2 și O2 trebuie să aloce o anumită cantitate de căldură pentru a forma o moleculă de apă, reacția adică H2 formarea O este exotermă.
Metoda 2 din 3:
Calculul Editare enthalpy


- De exemplu, ia în considerare reacția: H2 + F2 → 2HF. În acest caz, energia pentru a rupe legătura în molecula de H2 este de 436 kJ / mol, iar diferența de energie pentru F2 este de 158 kJ / mol. [1] În cele din urmă, energia necesară pentru formarea unei legături într-o moleculă HF de la H și F = -568 kJ / mol. [2] Recent, am multiplica valoarea de 2, din moment ce se obține în timpul reacției 2 moli de HF, adică 2 x -568 = -1136 kJ / mol. Adaugă valoarea:
+ 158 + 436 -1136 = -542 kJ / mol.


- De exemplu, luați în considerare următoarea reacție: C2 H5 OH + 3O2 → 2CO2 + 3H2 O. Știm că entalpia de formare este calculat: [3]
C2 H5 OH → 2C + 3H2 + 0.5O2 = 228 kJ / mol
2C + 2O2 → 2CO2 = -394 × 2 = -788 kJ / mol
3H2 + 1,5 O2 → 3H2O = -286 × 3 = -858 kJ / mol
Acum însumați numerele substanțelor înrudite obținute mai sus pentru a determina entalpia reacției: C2 H5 OH + 3O2 → 2CO2 + 3H2O,
+ + -788 228 -858 = -1418 kJ / mol.
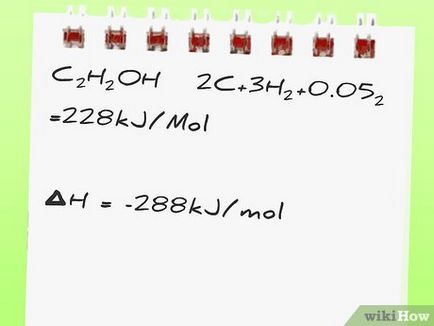

- În exemplu, rețineți că reacția de formare a produsului C2 H5 OH înregistrată invers. C2 H5 OH → 2C + 3H2 + 0.5O2 adică C2 H5 OH rupe, mai degrabă decât sintetizat. Prin urmare, semnul în fața entalpiei într-o reacție pozitivă 228 kJ \ mol, deși entalpia formării C2 H5 OH este -228 kJ \ mol.