Ce este o moleculă de proteină
Sub structura primară a proteinei se înțelege cantitatea și ordinea de alternare a resturilor de aminoacizi unite împreună prin legături peptidice în lanțul polipeptidic.
Lanțul polipeptidic are la un capăt conține liber, care nu sunt implicate în formarea legăturii peptidice, NH2 -în, această porțiune este menționată ca N-end. Pe partea opusă este liberă, nu sunt implicate în formarea legăturii peptidice, grupa HOOC este - C-terminal. În timpul începutul lanțului este primit capătul N-terminal, este aici că începe numerotarea resturilor de aminoacizi:
Secvența de aminoacizi a insulinei set F. Sanger (Universitatea Cambridge). Această proteină este format din două lanțuri de polipeptide. Un lanț este format din 21 de resturi de aminoacizi, altele cu lanț - de 30. Chains sunt legate prin două punți disulfurice (Figura 6).
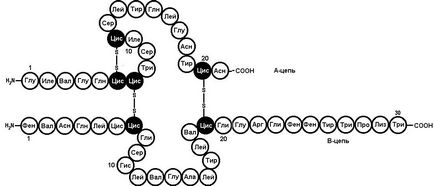
Fig. 6. Structura primară a insulinei umane
Pe transcrierea acestei structuri a fost petrecut 10 ani (1944 -. 1954 gg). În prezent, structura primară a multor proteine este determinată, procesul de determinare automată și nu reprezintă o problemă serioasă pentru cercetători.
Informații cu privire la structura primară a fiecărei proteine este codificată în gena (porțiunea ADN) și implementat în timpul transcripției (copierea informațiilor de pe mARN) și translație (sinteza lanțului polipeptidic). În legătură cu aceasta, este posibil să se stabilească structura primară a proteinei este, de asemenea, o structură cunoscută gena corespunzătoare.
Se poate vedea pe tipurile de relații taxonomice privind structura primară a proteinelor omoloage. Prin proteinele omoloage includ acele proteine care au diferite tipuri de aceeași funcție. Astfel de proteine au secvențe de aminoacizi similare. De exemplu, proteina C citocromului la majoritatea speciilor are o greutate moleculară relativă de aproximativ 12.500 și conține aproximativ 100 de resturi de aminoacizi. Diferențele în structura primară a citocromului c sunt proporționale cu două tipuri de diferența filogenetice dintre aceste specii. Deci citocrom c cal și drojdiile diferă în resturile de 48 de aminoacizi, carne de pui și rațe - două, citocromii ca pui și curcan sunt identice.
Structura secundară a unei proteine formate prin formarea de legături de hidrogen între grupurile de peptide. Două tipuri de structuri secundare: structura α-β-helix (sau strat pliat). Proteinele nu pot formează structura secundară sunt de asemenea prezente porțiuni ale lanțului polipeptidic.
α-Helix are forma unui arc. În formarea α-helix a fiecărui atom de oxigen al grupării peptidic formează o legătură de hidrogen cu un atom de hidrogen în timpul NH-grupe patrulea lant:
Fiecare rândul său, în spirală este conectat la alte multiple legături de hidrogen bobină spirală, care dă structura putere considerabilă. a-helix are următoarele caracteristici: diametrul elicei de 0,5 nm, un pas - 0,54 nm la fiecare rotație a elicei pentru 3,6 reziduuri de aminoacizi (Figura 7.).

Fig. 7. Model de helix, care reflectă caracteristicile sale cantitative
Amino grupuri laterale de acid îndreptat spre exteriorul spiralei (fig. 8).

Fig. 8. Modelul helix, reflectând dispunerea spațială a lanțurilor laterale
Dintre acizii naturali L-amino pot fi construite ca mana dreapta si elice stânga. Pentru cele mai multe proteine naturale caracteristice spirala dreapta. De D-aminoacizi, de asemenea, pot fi construite ca spirala din stânga și din dreapta. lanț polipeptidic Same constând dintr-un amestec de reziduu D-și L-aminoacizi care nu sunt capabile să formeze o spirală.
Unele resturi de aminoacizi a preveni formarea de α-helix. De exemplu, dacă un rând din circuit sunt câteva resturi încărcate pozitiv sau negativ de aminoacizi, astfel porțiune structuri elicoidale decide a-datorită repulsiei reciproce a radicalilor cu sarcină, cum ar fi. Hinder formarea de radicali helix resturi de aminoacizi având dimensiuni mari. Un obstacol în calea formării α-helix, este prezența în lanțul polipeptidic al reziduurilor de prolină (Fig. 9). In rest de prolină la atomul de azot formând o legătură peptidică cu un alt aminoacid, nu există nici un atom de hidrogen.
Fig. 9. prolină previne formarea helix
Prin urmare, restul de prolină este parte din lanțul polipeptidic nu este capabilă să formeze legătura de hidrogen intralant. In plus, atomul de azot din prolină face parte dintr-un inel rigid, ceea ce face imposibil să se rotească în jurul unei N comunicații - formarea C și helix.
De asemenea, este descris α-helix, și alte tipuri de helices. Cu toate acestea, ele sunt rare, mai ales pe distanțe scurte.
Formarea de legături de hidrogen între grupurile de peptide rezultate fragmente de lanț polipeptidic vecine în formarea de β-structură sau straturi pliate:

Spre deosebire de stratul de pliat α-helix are o formă în zig-zag similar unui acordeon (Fig. 10).

Fig. 10. Structura β-proteinei
Distinge straturi paralele și antiparalele îndoite. Paralel β-structură sunt formate între porțiunile lanțului polipeptidic, ale căror direcții coincid:

Antiparalelnye p structuri sunt formate între regiuni opuse de lanțului polipeptidic:
p-structuri pot fi formate între mai mult de două lanțuri de polipeptide:
Ca parte a unor structuri secundare de proteine pot fi furnizate numai α-helix în celelalte - numai p-structuri (paralele sau antiparalele, sau ambele, și altele), în al treilea, împreună cu porțiuni spiralized-alfa pot fi prezente și β-structură.
Multe proteine vtorichnoorganizovannye structura (α-helix -Structura) pliat într-un anumit fel, într-un globulă compact. Organizarea spațială a proteinelor globulare se numește structura terțiară. Astfel, structura terțiară caracterizează dispunerea tridimensională a secțiunilor de lanț polipeptidic în spațiu. În formarea structurii terțiare sunt implicate legături ionice și hidrogen, interacțiuni hidrofobe, forțe van der Waals. Stabilizează structura terțiară a punților disulfurice.
Structura terțiară a proteinelor definite prin secvența lor de aminoacizi. La comunicarea formarea poate avea loc între aminoacizii din lanțul polipeptidic situat la o distanță considerabilă. La proteine solubile radicali amino polari tind să apară pe suprafața moleculelor de proteine și cel puțin - în moleculă, radicalii hidrofobi sunt ambalate în interiorul compact care formează o regiune hidrofobă Globula.
În prezent, structura terțiară a multor proteine instalate. Luați în considerare două exemple.
Mioglobina - stocarea oxigenului in muschi - proteina de legare cu o greutate relativă 16700. Funcția sa de oxigen. In molecula are o catenă polipeptidică constând din resturi de acid 153 aminoacizi și hem, care joacă un rol important în legarea oxigenului.
Organizarea spațială a mioglobina stabilite prin activitatea Dzhona Kendryu si colegii sai (Fig. 11). In molecula proteinei conține opt regiuni alfa-elicoidale, care reprezintă 80% din toate resturile de aminoacizi. molecula mioglobina este foarte compact, se poate încadra într-un total de patru molecule de apă, aproape toți radicalii polari ai aminoacizilor sunt situate pe suprafața exterioară a moleculei, majoritatea dintre radicalii hidrofobi din moleculă este aproape de suprafață este un hem - grup non-proteine responsabile pentru legarea oxigenului.

Figura 11. Structura terțiară a mioglobinei
Ribonucleaza - proteină globulară. Acesta este secretat de celulele din pancreas, este - o enzimă care catalizează scindarea ARN-ului. Spre deosebire de mioglobina, molecula ribonucleaza are o foarte puțin regiunile helical și un număr suficient de mare de segmente, situate în β-conformație. Durabilitatea structurii terțiare a legăturilor de proteine disulfid da 4.
Multe proteine constau din mai multe, două sau mai multe subunități de proteine, sau ca molecule având o structuri secundare și terțiare specifice ținute împreună prin legături de hidrogen și legături ionice, interacțiunile hidrofobe, forțe van der Waals. Această organizare a moleculelor de proteină este numită structura cuaternară. și numite proteine oligomere ei înșiși. subunități individuale sau moleculă de proteină, ca parte a unei proteine numite oligomeric protomers.
Numărul de protomers în proteine oligomere pot varia foarte mult. De exemplu, creatin kinaza este format din doua protomers hemoglobinei - de la 4 protomers, ARN-polimerazei E.coli - enzimă responsabilă pentru sinteza ARN, - de la 5 protomers, piruvat dehidrogenaza complexe - de la 72 protomers. Dacă proteina este alcătuită din două protomers, este numit un dimer, patru - tetramer, șase - hexamerul (fig.12.). Cea mai mare parte a proteinei în moleculă oligomeric conține 2 sau 4 protomer. Compoziția proteinei oligomeric poate include aceleași sau diferite protomers. În cazul în care o parte din protomer proteinei constă din două identice, este - un homodimer. dacă este diferit - heterodimer.

Fig. 12. Proteinele oligomeri
Luați în considerare organizarea moleculei hemoglobinei. Funcția principală a hemoglobinei este de a transporta oxigenul de la plamani la tesuturi si dioxidul de carbon în direcția inversă. (. Figura 13) molecula constă din patru lanțuri de polipeptide, două tipuri diferite - cele două lanțuri de alfa și două lanțuri beta și hem. Hemoglobina este o proteină înrudită mioglobina. Structura secundară și terțiară a mioglobinei și hemoglobinei protomers sunt foarte similare. Fiecare protomer cuprinde hemoglobina, mioglobina ca 8 porțiuni spiralized oc ale lanțului polipeptidic. Trebuie remarcat faptul că structurile primare ale mioglobinei și hemoglobinei protomer resturi identice de acid numai 24 aminoacizi. Prin urmare, proteinele care sunt semnificativ diferite în structura primară poate avea organizare spațială similare și îndeplinesc funcții similare.

Fig. 13. Structura hemoglobinei